LA POLINEUROPATIA NEL LEONBERGER
Con il termine Polineuropatia ereditaria del Leonberger (LPN – Leonberger Polyneuropathy o ILP – Inherited Leonberger Polyneuropathy ) si intende un gruppo di patologie degenerative con manifestazioni cliniche simili ma geneticamente distinte che colpiscono il sistema nervoso periferico del cane. I ricercatori dell’Università di Berna in collaborazione con i ricercatori dell’università del Minnesota hanno identificato le mutazioni genetiche responsabili delle due differenti forme di polineuropatia (denominate in seguito LPN1 e LPN2) ed elaborato dei test genetici per individuarle.
SEGNI CLINICI
I soggetti affetti da polineuropatia possono manifestare una graduale e lenta intolleranza e resistenza all’esercizio fisico e sviluppare anomalie nell’andatura, come per esempio un esagerato sollevamento delle zampe posteriori, incrocio, barcollamento, andatura scoordinata, trascinamento di un arto così come una progressiva atrofia e ipotonia muscolare fino all’incapacità di reggere il proprio peso. Parallelamente i cani possono manifestare rumorosità del respiro, modifica dell’abbaio, difficoltà nella deglutizione, tosse dopo aver bevuto o mangiato, stridore nella respirazione a causa dell’ interessamento della laringe e dei nervi laringei della gola, fino ad arrivare alla paralisi della laringe.
Le biopsie effettuate sui cani affetti mostrano degenerazione delle fibre nervose e perdita di mielina, la sostanza che costituisce la guaina midollare delle fibre nervose e che ha la funzione di proteggere ed isolare la conduzione dello stimolo nervoso.
L’ età di inizio della manifestazione dei sintomi è variabile, da meno di 1 anno fino agli 11 anni di età. I cani affetti da un precoce esordio della malattia tendono a sviluppare i sintomi e gli stadi della patologia più gravi, mentre nei cani che manifestano i sintomi ad età avanzata la patologia sembra essere meno severa. Ad ogni modo questa patologia ha un grave impatto sulla qualità di vita del cane.
POLINEUROPATIA NEL LEONBERGER 1 – LPN 1
2010 _ L’università di Berna in collaborazione con l’università del Minnesota e l’Università San Diego – California ha individuato la mutazione causativa responsabile di una prima forma di polineuropatia e l’ha denominata LPN1. Questa mutazione sembra colpire circa il 20% dei soggetti che presentano neuropatie.
EREDITABILITA’
Si tratta nello specifico di una mutazione del gene ARHGEF10 caratterizzata da un’ereditarietà autosomica recessiva, ovvero un soggetto deve avere entrambe le copie del gene affetto dalla mutazione LPN1 (cioè un genotipo D/D) per sviluppare la patologia.
I tre possibili genotipi risultanti dal test genetico possono essere:
N/N cioè il soggetto è omozigote dominante e quindi sano e non portatore,
D/N cioè il soggetto è eterozigote e portatore sano,
D/D cioè, come abbiamo visto, il soggetto è omozigote recessivo cioè affetto dalla patologia.
Dal mese di luglio 2010 l’università del Minnesota e l’università di Berna è stato possibile effettuare un test per l’identificazione della mutazione LPN1 in un soggetto, inviando presso i laboratori un campione di siero.
Tutti i proprietari e gli allevatori che avessero dei soggetti in riproduzione sono stati invitati ad effettuare questo test genetico, al fine di limitare drasticamente l’incidenza e la diffusione di questa patologia nella razza.
Qui di seguito riportiamo lo scritto dell’Università di Berna, con le indicazioni sulla corretta interpretazione del risultato del test.
LPN1 Genetic Test Result Interpretation (Version June, 2017)
LPN1-N/N: A clear dog has no copies of the LPN1 gene mutation (this is also referred to as being homozygous normal). However, this result does not rule out the possibility that a dog could have, or be a carrier for, a different polyneuropathy mutation (including LPN2) that this test cannot detect. A LPN1 clear dog cannot produce a LPN1-D/D dog.
LPN1-D/N: A carrier/at risk dog has one copy of the LPN1 gene mutation (this is also referred to as being heterozygous). Having one copy of the mutated form of the LPN1 gene does not rule out the possibility that a dog may have a polyneuropathy caused by the LPN1 mutation or another mutation not detected by this test (including LPN2). LPN1 carriers will, on average, pass the LPN1 gene mutation on to half of their offspring.
LPN1-D/D: An affected dog has two copies of the LPN1 gene mutation (this is also referred to as being homozygous affected). Affected dogs typically develop neurological disease at or before 3 years of age (average 1.9 years of age), and clinical signs tend to be severe, often requiring surgical intervention of laryngeal paralysis. Affected dogs will pass one copy of this mutation on to all of their offspring.
Further Information
We are testing for a specific DNA segment deletion in the gene ARHGEF10; therefore this can be referred to as a gene mutation test. This situation is different from other types of genetic tests that describe only the identification of a DNA marker that could be very far away from the true disease gene, and not be as highly predictive as desired. About 11% of all diagnosed cases of Leonberger polyneuropathy were LPN1-D/D.
We have designated the letter D to indicate the mutant form of the LPN1 gene and N to indicate the normal form of the gene. A dog’s particular combination of N or D forms of the gene is known as its genotype. The genotype of a clear dog is designated as N/N, they have no copies of the LPN1 gene mutation. N/N dogs do not have LPN1; however, some dogs may develop neuropathy with similar clinical and histopathological signs due to LPN2 or other as-yet-unidentified mutations. Most dogs with the D/D genotype identified to date are affected with LPN1 and have developed clinical signs of neurologic disease, typically by 3 years of age or younger. At present ~24% of dogs in our research population with a phenotype consistent with or diagnosis of unexplained polyneuropathy have the LPN1-D/N genotype. The frequency of the LPN1-D/N genotype in healthy control dogs is 12.5%. The average age that clinical signs are first noted in these LPN1-D/N dogs, if they develop at all, is 6 years.
Due to other causes of neuropathy in Leonbergers, the exact mode of inheritance of the LPN1 form of neuropathy cannot yet be stated for certain. While it is possible that LPN1 is dominantly inherited, with a dose dependent nature to the disease (more copies = worse disease), it could also be recessively inherited, meaning that LPN1-D/N and LPN1- N/N dogs with clinical signs have another form of neuropathy, such as LPN2. With either inheritance model, producing a puppy with severe, early-onset LPN caused by the mutant LPN1 gene would require that both parents be either carriers (D/N) or affected (D/D). Below are the chances any given puppy in a litter from the indicated mating will have the genotype of clear, carrier or affected. Matings that produce, or are comprised of an affected dog are not recommended and are shown in red.
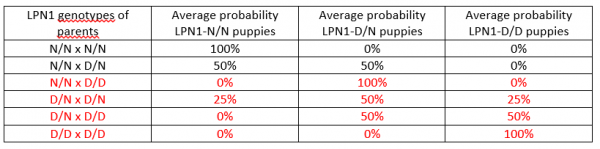
Breeding Recommendations
Until other potential disease-causing mutations are discovered, it remains impossible for us to determine with certainty why some LPN1-D/N dogs develop disease. It could be due to the single copy of the LPN1 deletion, or it could be due to another form of disease (yet to be elucidated), or even a combination of the two.
As long as it is not absolutely clear that LPN1-D/N dogs will develop neurological disease, we do not recommend automatic exclusion of these dogs from the breeding population. We recommend testing breeding potential puppies in litters of LPN1-D/N x LPN1-N/N matings, and if all other considerations are equal, preferentially the N/N pups (50%) should be kept for future breeding. However, if the LPN1-D/N pup is preferred it is okay to keep them for future breeding. In a global group of more than 7,000 Leonbergers which have been submitted to our laboratories, ~ 12% were LPN1-D/N carrier dogs. Immediately eliminating all D/N dogs from breeding may have negative consequences for the genetic diversity of the breed. Important lines within the breed should be maintained; for example, if an important line is about to vanish, limited use of LPN1-D/N animals may be used to preserve them.
Within the Leonberger breed LPN1, LPN2, and LEMP genotypes must all be considered when selecting breeding pairs. LPN1 affected dogs (D/D) and LPN2 affected dogs (both D/N & D/D) are not recommended to be bred. Within each mating pair, at least one parent should be LPN1 and LEMP clear (N/N).
One final word of caution
It is important to remember that this LPN1 test is diagnostic for only one of possibly several genetic risk factors for polyneuropathy. Thus, it is still possible that affected offspring with a different genetic form of polyneuropathy could occur, even from a mating of two dogs that both have been tested N/N for the LPN1 mutation. To that end, we also recommend that both dogs in a breeding pair be LPN2 clear, and free of any signs of neurological disease, regardless of genotype, because this test can only detect one polyneuropathy mutation.
Fonti
- Shelton, G. D. et al. (2003.): Inherited polyneuropathy in Leonberger dogs: A mixed or intermediate form of Charcot‐Marie‐Tooth disease? Muscle & Nerve 27(4):471 – 477 April 2003.
- Ekenstedt KJ, Becker D, Minor KM, Shelton GD, Patterson EE, et al. (2014) An ARHGEF10 Deletion Is Highly Associated with a Juvenile-Onset Inherited Polyneuropathy in Leonberger and Saint Bernard Dogs. PLoS Genet 10(10): e1004635. doi:10.1371/journal.pgen.1004635
- https://journals.plos.org/plosgenetics/article?id=10.1371/journal.pgen.1004635
- http://www.leonberger.ch/pdf/Test%20Genetico%20per%20la%20Polineuropatia%20ereditaria%20nel%20Leonberger.pdf (giugno 2010)
- https://www.leohealth.org/images/lpn.pdf
- https://journals.plos.org/plosgenetics/article/file?type=supplementary&id=info:doi/10.1371/journal.pgen.1004635.s001
POLINEUROPATIA NEL LEONBERGER 2 – LPN2
2014 _ Gli ulteriori studi in merito alle patologie neurodegenerative nel Leonberger evidenziano la presenza di una seconda differente mutazione, relativa al gene GJA9. Questo gene codifica le giunzioni cellulari, ovvero le connessioni tra le cellule che si connettono direttamente al citoplasma delle cellule di contatto. La mutazione causante questa seconda forma di neuropatia che viene chiamata LPN2, sembra spiegare approssimativamente il 25% di tutti i casi di polineuropatia; quindi, assieme a LPN1 abbiamo ora dei test in grado di spiegare nel loro complesso circa il 50% di tutti i casi diagnosticati di polineuropatia nella razza.
EREDITABILITA’
A differenza della prima forma di polineuropatia LPN1, questa seconda polineuropatia è una patologia autosomica dominante, ciò significa che il carattere patologico si manifesta quando è alterata anche una sola copia del gene.
I tre possibili genotipi risultanti dal test genetico possono essere:
N/N cioè il soggetto è omozigote recessivo e quindi sano e non portatore,
D/N cioè il soggetto è eterozigote e quindi malato,
D/D cioè il soggetto è omozigote dominante cioè affetto dalla patologia.
Ne consegue che è di fondamentale importanza testare i soggetti in riproduzione anche per l’ identificazione del relativo genotipo riguardante questa seconda forma di neuropatia. Dal 2014 è infatti disponibile un test per la LPN2, sempre rivolgendosi agli istituti di ricerca sopra citati.
Qui di seguito riportiamo lo scritto dell’Università di Berna, con le indicazioni sulla corretta interpretazione del risultato del test.
LPN2 Genetic Test Result Interpretation (Version June, 2017)
LPN2-N/N: A clear dog has no copies of the LPN2 gene mutation (this is also referred to as being homozygous normal). However, this result does not rule out the possibility that a dog could have, or be a carrier for, a different polyneuropathy mutation (including LPN1) that this test cannot detect.
LPN2-D/N: A heterozygous affected/susceptible dog has one copy of LPN2 gene mutation. The average age that owners first notice clinical signs of PN in heterozygous affected dogs, if they develop at all, is 6 years. On average, heterozygous affected dogs will pass along the LPN2 mutation to half of their offspring, this half will be LPN2 affected/susceptible.
LPN2-D/D: A homozygous affected/susceptible dog has two copies of the LPN2 gene mutation. In a limited number of homozygous affected dogs, the average age of onset is 4.5 years. Affected dogs will pass one copy of this mutation on to all of their offspring, and all will be LPN2 affected/susceptible
Further Information
We are testing for a specific DNA segment deletion in the GJA9 gene; therefore this can be referred to as a gene mutation test. This situation is different from other types of genetic tests that describe only the identification of a DNA marker that could be very far away from the true disease gene, and not be as highly predictive as desired. The LPN2 mutation is inherited in a partially penetrant autosomal dominant manner. Autosomal dominant means that only one copy of the mutation is required to show signs of disease; partially penetrant means that among genetically affected dogs (LPN2-D/N & LPN2-D/D) not all will show obvious clinical signs in their lifetime. This mutation explains ~20% of all diagnosed cases of Leonberger polyneuropathy
We have designated the letter D to indicate the mutant (LPN2) form of the gene and N to indicate the normal form of the gene. A dog’s particular combination of N or D forms of the gene is known as its genotype. The genotype of a clear dog is designated as N/N , they have no copies of the LPN2 mutation. LPN2-N/N dogs do not have LPN2. However, some dogs may develop neuropathy with similar clinical and histopathological signs due to LPN1 or other as-yet-unidentified mutations. LPN2-D/N and LPN2-D/D dogs are both considered to be affected/susceptible to PN caused by the LPN2 mutation. The age of onset in LPN2 affected dogs is quite broad, with dogs beginning to show signs from 1 year of age all the way through 10 years of age, or not at all in their lifetime.
In our research population of LPN2 affected/susceptible Leonbergers, ~60% of dogs showed signs of disease by 8 years of age. Within their lifetime, four out of five LPN2 affected/susceptible dogs showed signs of disease or biopsied as affected. Severity of disease in the parent may not be indicative of the severity observed in their offspring. This is particularly problematic for breeding dogs, which may have been bred many times before the onset of clinical disease.
Below are the chances any given puppy in a litter from the indicated mating will have the genotype of clear or affected (D/N or D/D). Matings that produce, or are comprised of an affected dog are not recommended and are shown in red.
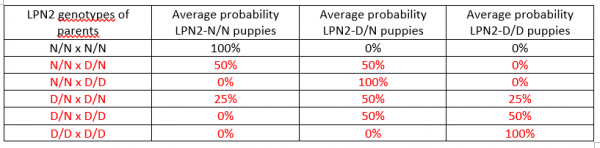
Breeding Recommendations
LPN2 is a dominantly inherited polyneuropathy, requiring only a single copy of the mutation to produce disease. Due to the dominant nature of the mutation, and its relatively low frequency (~6%) in the breed at present, we recommend immediate removal of LPN2-D/N and LPN2-D/D dogs from the breeding population to prevent the production of LPN2 affected/susceptible offspring.
Within the Leonberger breed LPN1, LPN2, and LEMP genotypes must all be considered when selecting breeding pairs. LPN1 affected dogs (D/D) and LPN2 affected dogs (both D/N & D/D) are not recommended to be bred. Within each mating pair, at least one parent should be LPN1 and LEMP clear (N/N).
One final word of caution
It is important to remember that this LPN2 test is diagnostic for only one of possibly several genetic risk factors for polyneuropathy. Thus, it is still possible that affected offspring with a different genetic form of polyneuropathy could occur, even from a mating of two dogs that both have been tested N/N for the LPN2 mutation. To that end, we also recommend that at least one dog in a breeding pair be LPN1 clear, and that both dogs in a breeding pair be free of any signs of neurological disease, regardless of genotype, because this test can only detect one polyneuropathy mutation
LE DUE POLINEUROPATIE A CONFRONTO

Fonti
- Becker D. et al (2017): A GJA9 frameshift variant is associated with polyneuropathy in Leonberger dogs. MC Genomics 18:662.
- Ekenstedt KJ, Becker D, Minor KM, Shelton GD, Patterson EE, et al. (2014) An ARHGEF10 Deletion Is Highly Associated with a Juvenile-Onset Inherited Polyneuropathy in Leonberger and Saint Bernard Dogs. PLoS Genet 10(10): e1004635. doi:10.1371/journal.pgen.1004635
- http://www.leonberger.it/nuovo/wp-content/uploads/2014/07/LPN2_italiano_2014Jul01.pdf
- https://www.genetics.unibe.ch/e20974/e85824/e95237/e102195/LPN_Poster_June2017_ger.pdf
POLINEUROPATIA NEL LEONBERGER 3 – LPPN3
31 ottobre 2020 _ Ulteriore test genetico per la Paralisi Laringea e la Polineuropatia
Negli ultimi 10 anni moltissimi proprietari e allevatori di Leonberger hanno effettuato i test genetici a disposizione per comprendere le condizioni di salute del proprio cane e per progettare i giusti accoppiamenti al fine di ridurre l’incidenza della polineuropatia. In effetti nessun Leonberger nato dopo il 2011 con due copie della mutazione LPN1 è stato registrato nella banca dati. Allo stesso tempo, questi test vengono utilizzati con effetti simili in altre razze nelle quali sono state individuate le stesse mutazioni o mutazioni strettamente correlate a quelle identificate nel Leonberger. A tal proposito, i proprietari e le organizzazioni hanno di che essere orgogliosi, dal momento che si sta aprendo la strada al miglioramento genetico di questa razza e di altre razze, in particolar modo nel San Bernardo. Le Università impegnate nella ricerca sono molto onorate di lavorare con noi in questo impegno.
Il Leonberger, come molte altre razze, può soffrire di disturbi neurologici, in particolare di forme di polineuropatia che portano spesso ad una diagnosi di paralisi laringea. La paralisi laringea può essere il primo sintomo clinico di polineuropatia e può presentarsi senza che si manifestino anomalie nell’andatura. Nel 2010 e nel 2014 sono state individuate dalle Università di Berna e del Minnesota due forme ereditarie di polineuropatia/ paralisi laringea, denominate polineuropatia nel Leonberger di tipo 1 (LPN1) e di tipo 2 (LPN2), di cui sono stati sviluppati i test genetici. Inoltre nel 2017 le due università hanno elaborato un test genetico per un altro disturbo neurologico, denominato leucoencefalomielopatia (LEMP), il quale, anche se non si tratta di una polineuropatia, è causa di una grave patologia al sistema nervoso.
Le forme di polineuropatia di tipo 1 e 2 non spiegano tutti i casi evidenti di polineuropatia/paralisi laringea nel Leonberger, e ciò porta a chiedersi se esistano altre spiegazioni genetiche.
In quest’ottica siamo felici di annunciare la scoperta di un terzo fattore genetico che causa polineuropatia e paralisi laringea nel Leonberger. Per comodità e chiarezza questa forma è stata denominata LPPN3. E’ interessante notare che questa mutazione di recente scoperta compare anche nel San Bernardo, nei Labrador Retriever e in molte altre razze.
L’età media di insorgenza dei primi sintomi clinici nei cani con LPPN3 è di 3.4 anni nel Leonberger, 2.1 anni nel San Bernardo e 7.5 anni nel Labrador Retriever. Facendo un confronto, la LPN1 compare nel Leonberger e nel San Bernardo con entrambe le copie del gene affetto dalla mutazione (D/D) all’età media rispettivamente di 2.2 anni e 1.6 anni. I Leonberger affetti dalla mutazione LPN2 hanno un’età media di insorgenza di 6.2 anni.
Le tre mutazioni LPN1, LPN2 e LPPN3 sono ad oggi responsabili di quasi la metà di tutti i casi di Leonberger con polineuropatia/paralisi laringea registrati nella banca dati. Inoltre, dalla scoperta della mutazione LPPN3, possiamo affermare che l’11,5% di un gruppo di più di 2700 Leonberger sono portatori della mutazione LPPN3. Questo ulteriore test genetico consente alla comunità del Leonberger di fare dei grandi passi avanti nel controllo della diffusione di questi terribili disturbi e nella salvaguardia della salute della popolazione.
Vogliamo ricordare che le diverse forme genetiche di polineuropatia hanno diverse modalità di ereditarietà. Per la LPN1, è stata osservata l’insorgenza precoce in cani con due copie della mutazione LPN1 (D/D), ma si può riscontrare un esordio più tardivo spesso, ma non sempre, in cani con una singola copia della mutazione (D/N); per la LPN2, l’insorgenza della patologia richiede una sola copia della mutazione LPN2 (D/N); e ora, l’esordio della patologia causata dalla LPPN3 richiede entrambe le copie del gene affette dalla mutazione LPPN3 (D/D). L’ereditarietà della LPNN3 è la stessa della mutazione LEMP e perciò i portatori eterozigoti (D/N) della LPPN3 possono essere accettati in riproduzione.
Le Università del Minnesota e di Berna inizieranno ad offrire il test genetico per l’individuazione della mutazione LPPN3, oltre ai test LPN1, LPN2 e LEMP, a partire dal 2 novembre. Maggiori dettagli sono disponibili nei rispettivi siti web, assieme alle interpretazioni dei vari possibili risultati del test.
Per l’Università di Berna:
https://www.genetics.unibe.ch/services/dog/gene_tests_in_the_leonberger/index_eng.html
Per l’Università del Minnesota:
https://vetmed.umn.edu/research/labs/canine-genetics-lab/genetic-testing/leonberger-polyneuropathy
Le Università in oggetto forniranno i risultati a gratis ai proprietari di cani affetti che abbiano fornito un esame neurologico o una relazione relativa alla laringoscopia.
SINTOMI
I cani affetti da questa forma di polineuropatia mostrano sintomi clinici tipici tra cui difficoltà respiratoria, intesa come respiro rumoroso e rauco. Ulteriori sintomi, che si sono osservati in modo variabile tra i cani, includono difficoltà nella deglutizione, cambiamenti nella frequenza e nella qualità dell’abbaio, un’andatura scoordinata e con passi effettuati alzando molto le zampe, inciampi, intolleranza all’esercizio e atrofia muscolare. Come molti disturbi neurologici, non esiste una cura efficace per la LPN. Dal momento che in molti casi il cane non prova dolore ma è fortemente condizionato nella sua qualità di vita, in particolar modo per la frequente perdita della normale funzionalità della laringe, i proprietari sono invitati a chiedere un parere medico.
EREDITABILITA’
La LPPN3 è una patologia autosomica recessiva, ovvero un soggetto deve avere entrambe le copie del gene affette dalla mutazione LPPN3 (cioè un genotipo D/D) per sviluppare la patologia. I cani omozigoti per la mutazione mostreranno quindi i sintomi.
I tre possibili genotipi risultanti dal test genetico possono essere:
N/N cioè il soggetto è omozigote dominante e quindi sano e non portatore,
D/N cioè il soggetto è eterozigote e portatore sano,
D/D cioè il soggetto è omozigote recessivo cioè affetto dalla patologia.
Qui di seguito riportiamo lo scritto dell’Università di Berna, con le indicazioni sulla corretta interpretazione del risultato del test.
LPPN3 Genetic Test Result Interpretation
We have designated the letter D to indicate the mutant form of the LPPN3 gene and N to indicate the normal form of the gene. A dog’s particular combination of N or D forms of the gene is known as its genotype. The three possible genotypes are listed below.
LPPN3-N/N: A clear dog has no copies of the LPPN3 gene mutation (this is also referred to as being homozygous normal). LPPN3-N/N dogs do not have LPPN3. However, this result does not rule out the possibility that a dog could have, or be a carrier for, a different polyneuropathy mutation (including LPN1 and LPN2) that this test cannot detect. An LPPN3- clear dog cannot produce LPPN3-D/D offspring.
LPPN3-D/N: A carrier dog has one copy of the LPPN3 gene mutation (this is also referred to as being heterozygous). Having one copy of the mutated form of the LPPN3 gene does not rule out the possibility that a dog may have a polyneuropathy caused by another mutation not detected by this test (including LPN1 and LPN2). LPPN3 carriers will, on average, pass the LPPN3 gene mutation on to half of their offspring.
LPPN3-D/D: An affected dog has two copies of the LPPN3 gene mutation (this is also referred to as being homozygous affected). Affected dogs typically develop the neurological disease at or before 5 years of age (average 3.4 years of age), and clinical signs tend to be severe, often requiring a surgical intervention of laryngeal paralysis. LPPN3-affected dogs will pass one copy of this mutation on to all of their offspring.
Further Information on LPPN3
The LPPN3 gene test is a so-called direct genetic test. This means that the causal specific DNA segment change in the CNTNAP1 gene is detected directly. This situation is different from other types of genetic tests that describe only the identification of a DNA marker that could be far away from the true disease gene, and not be as highly reliable as a direct genetic test.
The LPPN3 mutation is inherited in an autosomal recessive manner meaning that two copies of the mutation are required to show signs of disease. To produce a puppy with severe, youngonset polyneuropathy with laryngeal paralysis caused by the mutant LPPN3 gene, it would require that both parents are either LPPN3-D/N carriers or LPPN3-D/D affected. This mutation explains ~3% of all diagnosed cases of Leonberger polyneuropathy.
The LPPN3 type of polyneuropathy-affected dogs typically show breathing difficulties, often described as noisy or raspy breathing. Additional clinical signs, which were noted variably among the dogs, included difficulty swallowing, changes in barking frequency and quality, highstepping and uncoordinated gait, stumbling and tripping, exercise intolerance, and muscle atrophy. Like many neurological diseases, there is no effective treatment for LPN. Since in most cases the dog is not in pain but is strongly restricted in its quality of life, especially due to the frequent loss of normal function of the larynx, owners are encouraged to ask a veterinarian for advice.

Breeding Recommendations
LPPN3 is a recessively inherited form of polyneuropathy. In general, LPPN3-D/D dogs should not be used for breeding. We do recommend avoiding matings that have the potential to produce LPPN3-affected (D/D) offspring. Due to the low frequency of LPPN3-D/D dogs (<1%) in the breed at present, we recommend immediate removal of LPPN3-D/D dogs from the breeding population and pairing the LPPN3-D/N dogs only with LPPN3-N/N dogs to prevent the production of LPPN3-affected/susceptible offspring. We do not recommend an automatic exclusion of LPPN3-D/N dogs from the breeding population. Among our global biobank of Leonbergers tested to-date, ~11.5% were LPPN3-D/N carriers. Immediately eliminating all LPPN3-D/N dogs from breeding may have negative consequences for the genetic diversity of the breed.><1%) in the breed at present, we recommend immediate removal of LPPN3-D/D dogs from the breeding population and pairing the LPPN3-D/N dogs only with LPPN3-N/N dogs to prevent the production of LPPN3-affected/susceptible offspring. We do not recommend an automatic exclusion of LPPN3-D/N dogs from the breeding population. Among our global biobank of Leonbergers tested to-date, ~11.5% were LPPN3-D/N carriers. Immediately eliminating all LPPN3-D/N dogs from breeding may have negative consequences for the genetic diversity of the breed.
Within the Leonberger breed LPN1, LPN2, LPPN3, and LEMP genotypes must all be considered when selecting breeding pairs. No affected dogs (LPN1-D/D, LPN2-D/N & LPN2- D/D, LPPN3-D/D, LEMP-D/D) should be bred. Within each mating pair, at least one parent should be LEMP-clear (N/N), LPN1-clear (N/N), LPPN3-clear (N/N), and both parents should be LPN2-clear (N/N).
One final word of caution
Since the introduction of the LPN genetic tests, polyneuropathy has not been completely eliminated from the Leonberger population. It is important to remember that these tests are diagnostic for only three (LPN1, LPN2, LPPN3) of possibly several genetic risk factors for polyneuropathy. Thus, it is still possible that affected offspring with a different genetic form of polyneuropathy could occur, even from a mating of two dogs that both have been tested N/N for the LPN mutations. This may be a form of neuropathy with similar clinical and histopathological signs due to other as-yet-unidentified mutations. However, the three LPN gene tests can reliably detect three forms of severe LPN and significantly reduce the overall incidence of polyneuropathy in the Leonberger breed. Finally, we strongly recommend both dogs in a breeding pair to be free of any signs of laryngeal paralysis or other neurological disease, regardless of genotype.
Fonti
- https://www.genetics.unibe.ch/forschung/dokumente_hund/polyneuropathie_beim_leonberger_lpn/index_ger.html
- https://www.genetics.unibe.ch/unibe/portal/fak_vetmedizin/c_dept_dcr-vph/h_inst_genetics/content/e20974/e85824/e95237/e102197/LPN_EN_Interpretation_2020Oct31_eng.pdf
- https://vetmed.umn.edu/research/labs/canine-genetics-lab/genetic-testing/leonberger-polyneuropathy
